Ensayos clínicos
Como parte de nuestra misión, Dup15q Alliance busca unir familias, investigadores y profesionales; y promover la investigación, la concientización y el empoderamiento de las personas con síndrome dup15q mediante el avance de investigaciones innovadoras y tratamientos terapéuticos que cambian la vida. Dup15q Alliance respalda y financia formalmente la investigación y colabora con investigadores interesados en la investigación sobre las duplicaciones del cromosoma 15q mediante la difusión de información de investigación y la promoción de oportunidades para que las familias de Dup15q Alliance participen en estudios de investigación y oportunidades de ensayos clínicos.
Elegir participar en un ensayo clínico es una decisión personal importante. A menudo es útil hablar con un médico, familiares o amigos sobre la decisión de participar en un ensayo clínico.
¡Regístrese para recibir nuestras NUEVAS alertas de texto sobre investigaciones y ensayos clínicos! Puede darse de baja de las alertas de texto en cualquier momento.
Uso este enlace debajo o Envíe "Alertas" al (847) 744-8904 ¡inscribirse!
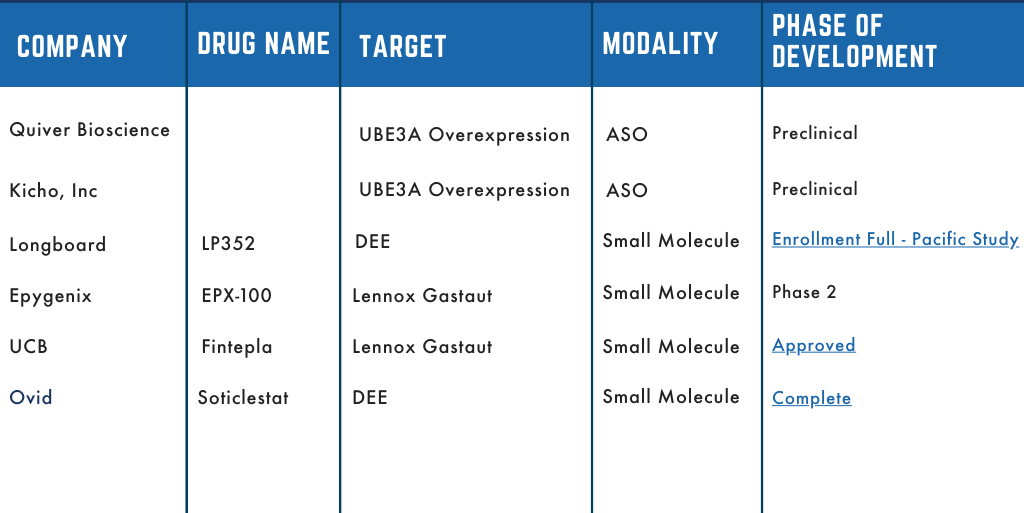
Tubería terapéutica Dup15q
La Alianza Dup15q ha estado a la vanguardia de los esfuerzos de colaboración con las partes interesadas en los espacios académico y farmacéutico. Nuestro objetivo es acelerar los esfuerzos de investigación para desarrollar intervenciones terapéuticas para las personas con Dup15q. Varias de esas asociaciones se han trasladado al desarrollo clínico y estamos encantados de compartir nuestra cartera. La tubería describe qué compañía está desarrollando el tratamiento, el nombre del activo/fármaco, el objetivo del fármaco y la etapa de desarrollo.
Estén atentos a medida que estos medicamentos avanzan en el desarrollo, la tubería se actualizará para reflejar su etapa de progresión.
¿Qué es un ensayo clínico?
Los ensayos clínicos son estudios de investigación que involucran a participantes humanos que se realizan para probar nuevos tratamientos y medicamentos. Solo se puede realizar un ensayo clínico si se han tomado todas las precauciones posibles para proteger la seguridad del paciente y cuando hay razones para creer que la nueva terapia mejorará la atención, la calidad de vida y otras cosas. Todos los ensayos clínicos se llevan a cabo de acuerdo con los Principios de Buena Práctica Clínica (GCP), que son supervisados por comités de ética independientes (IEC e IRB).
¿Cual es el tratamiento?
Nuevos medicamentos/dispositivos primero se prueban como un tratamiento a través de una extensa investigación de laboratorio. Si la investigación de laboratorio inicial tiene éxito, los investigadores envían los datos a la Administración de Alimentos y Medicamentos (FDA) para su aprobación para continuar la investigación en ensayos clínicos.
Medicamentos/dispositivos ya existentes que se utilizan para otros diagnósticos a menudo se utilizan en ensayos clínicos como una posible nueva opción de tratamiento.
¿Por qué participar en un ensayo clínico?
Se requieren ensayos clínicos para cualquier terapia nueva antes de la aprobación de la FDA. Las mejoras importantes en la atención médica para trastornos raros como el síndrome dup15q serían imposibles sin participantes voluntarios. Los participantes en ensayos clínicos pueden desempeñar un papel más activo en su propia atención médica, obtener acceso a nuevos tratamientos de investigación antes de que estén ampliamente disponibles y ayudar a otros contribuyendo a la investigación médica. Cuantas más personas participen en los ensayos clínicos, más rápido se podrán probar los medicamentos, los tratamientos y los cambios en el estilo de vida, y más rápido las personas podrán obtener una mejor atención.
¿Cómo ayuda la participación en un ensayo clínico a la comunidad Dup15q?
Necesitamos tener una cierta cantidad de pacientes en la comunidad Dup15q inscritos en ensayos de medicamentos para garantizar que esté disponible para todos los afectados por el síndrome Dup15q cuando salga al mercado.
Cuando se desarrollan nuevos tratamientos/medicamentos para abordar trastornos o síntomas de trastornos, los desarrolladores eligen poblaciones de pacientes para centrarse en la eficacia y la efectividad en ese trastorno en particular, de modo que cuando el medicamento pasa a los siguientes pasos de aprobación, ese trastorno y los datos de su efectividad entra en la indicación (que los trastornos se enumeran como un área de tratamiento para el fármaco).
Fases de un ensayo clínico
Cada fase está diseñada para responder a ciertas preguntas y mantener a las personas que participan lo más seguras posible. Los resultados de estas fases muestran si el nuevo fármaco o tratamiento es razonablemente seguro y eficaz.
Fase 1
¿Es seguro para los humanos?
Un ensayo clínico de Fase 1 prueba un nuevo tratamiento potencial en personas por primera vez, a veces llamado "primero en estudios en humanos". El objetivo principal de esta prueba es determinar si el tratamiento es seguro para los humanos.
- Realizado con voluntarios sanos y enfatiza la seguridad. Puede inscribir a los pacientes que tienen la enfermedad.
- Descubra cuáles son los eventos adversos más frecuentes y graves de la terapia.
- Comprender cómo se metaboliza y excreta la terapia.
- Determinar los niveles seguros que se administrarán
Fase 2
¿Es seguro y efectivo para la enfermedad objetivo?
El objetivo de un ensayo de fase 2 es averiguar si la nueva terapia trata de forma segura y eficaz la enfermedad de destino. Los datos se recopilan durante unos meses a 2 años.
- Requiere más participantes, y estos participantes deben tener la enfermedad que se pretende tratar con la nueva terapia.
- Evaluación continua de la seguridad y seguimiento de eventos adversos a corto plazo.
- Determinar si la terapia funciona como se espera en personas que tienen una determinada enfermedad o afección.
- Puede comparar a los participantes que reciben la terapia con participantes similares que reciben una sustancia inactiva (llamada placebo).
Fase 3
¿Se pueden confirmar los hallazgos de la fase 2?
El objetivo de los ensayos de la Fase 3 es confirmar o refutar los hallazgos realizados en la Fase 2. Los datos se recopilan durante 1 a 4 años.
- Supervisar los efectos secundarios a corto y largo plazo
- Determine si la terapia continúa funcionando como se esperaba en un grupo más grande de pacientes.
- Puede incluir la recopilación de datos para determinar la dosis más efectiva.
Fase 4
¿Funciona como se espera en el “mundo real”?
El objetivo de estos ensayos clínicos de Fase IV es evaluar el desempeño del nuevo tratamiento en el “mundo real”. Los datos se recopilan durante muchos años. Esto es importante porque antes de su aprobación, el nuevo tratamiento solo se examinó en un entorno de estudio.
- Ocurren después de que la FDA haya aprobado una terapia para su comercialización.
- Recopilar información adicional sobre la seguridad de una terapia, eficaciay uso óptimo.
- Inscriba a una gran población de pacientes, con requisitos de elegibilidad determinados por las indicaciones aprobadas por la FDA.
Preguntas frecuentes sobre ensayos clínicos
La Biblioteca Nacional de Medicina de EE. UU. mantiene un sitio web, www.clinicaltrials.gov. Este sitio web proporciona una breve descripción general de la investigación clínica, información para posibles participantes en el estudio clínico y un glosario de palabras comunes utilizadas en ClinicalTrials.gov.
¿Quién puede participar en un ensayo clínico?
Cada ensayo clínico tiene un protocolo que describe quién es elegible para participar en la investigación. Cada estudio debe incluir solo personas que cumplan con los requisitos para ese estudio. Estos son los criterios de elegibilidad del estudio.
Los criterios de elegibilidad son diferentes para cada ensayo. Estos criterios se basan en los objetivos del estudio y se utilizan para identificar a los participantes apropiados, mantenerlos seguros y ayudar a garantizar que los investigadores puedan encontrar la nueva información que necesitan. Incluyen factores tales como la edad, el tipo y la etapa de una enfermedad, el historial de tratamiento previo y otras condiciones médicas.
¿Por qué participar en un ensayo clínico?
Se requieren ensayos clínicos para cualquier terapia nueva antes de la aprobación de la FDA. Las mejoras importantes en la atención médica para trastornos raros como el síndrome dup15q serían imposibles sin participantes voluntarios.
Los participantes en ensayos clínicos pueden desempeñar un papel más activo en su propia atención médica, obtener acceso a nuevos tratamientos de investigación antes de que estén ampliamente disponibles y ayudar a otros contribuyendo a la investigación médica.
Cuantas más personas participen en los ensayos clínicos, más rápido se podrán probar los medicamentos, los tratamientos y los cambios en el estilo de vida, y más rápido las personas podrán obtener una mejor atención. Los ensayos clínicos tienen muchos beneficios médicos potenciales, que incluyen:
- Identificar tratamientos efectivos para las generaciones futuras
- Acelerar la investigación de tratamientos nuevos e innovadores
- Reducir el costo de la terapia a través de una mejor comprensión de qué pacientes pueden beneficiarse de un tipo específico de terapia
- Proporcionar a los investigadores datos más completos
¿Cuáles son los riesgos?
Un ensayo clínico solo puede llevarse a cabo si se han tomado todas las precauciones posibles para proteger la seguridad del paciente, y un fármaco en investigación solo puede probarse si existe una posibilidad real de beneficio terapéutico. Todos los ensayos clínicos se llevan a cabo de acuerdo con los Principios de Buena Práctica Clínica (GCP), que son supervisados por comités de ética independientes (IEC e IRB).
- El médico que dirige un ensayo clínico se asegurará de que cada paciente invitado a participar reciba información sobre posibles eventos adversos y tenga tiempo para considerar los riesgos.
- Los pacientes tienen tiempo para reflexionar antes de decidir si participar en un ensayo. Si deciden participar, se les explicarán los riesgos y se les pedirá que confirmen que conocen los procedimientos, los riesgos y las limitaciones del estudio.
- Los pacientes que participan en ensayos clínicos reciben el más alto grado de protección durante todo el estudio mediante supervisión biológica, médica y clínica.
- Los pacientes pueden decidir en cualquier momento retirarse del estudio.
¿Cómo ayuda la participación a otros en la comunidad dup15q?
Necesitamos tener una cierta cantidad de pacientes en la comunidad Dup15q inscritos en ensayos de medicamentos para garantizar que esté disponible para todos los afectados por el síndrome Dup15q cuando salga al mercado.
Cuando se desarrollan nuevos tratamientos/medicamentos para abordar trastornos o síntomas de trastornos, los desarrolladores eligen poblaciones de pacientes para centrarse en la eficacia y efectividad en ese trastorno en particular, de modo que cuando el medicamento pasa a los siguientes pasos de aprobación, ese trastorno y los datos de su efectividad entra en la indicación (que los trastornos se enumeran como un área de tratamiento para el medicamento)
¿Qué sucede durante el ensayo clínico?
Antes de que alguien se una a un estudio en cualquier fase como participante, se reunirá con los investigadores que realizan el ensayo para analizar los aspectos relevantes del estudio y revisar el formulario de consentimiento informado. Específicamente, cada estudio variará en términos de quién puede participar, cuántos participantes se necesitan, qué pruebas se usarán, cuánto durará el estudio y cómo se analizarán los datos.
También variará en términos del tiempo, dinero y energía que usted y su familia necesitarán si decide participar. Debe hacer tantas preguntas a los investigadores que realizan el ensayo como sea posible para obtener la información que necesita para decidir si la participación es adecuada para usted y su familia.
Durante el ensayo clínico, su equipo de estudio del ensayo clínico, que incluye médicos, enfermeras y otros profesionales de la salud, que le brindarán atención médica. Verifican la salud del participante al comienzo del ensayo, brindan instrucciones específicas para participar en el ensayo, realizarán las pruebas y los exámenes relacionados con el estudio, supervisan atentamente al participante durante el ensayo y se mantienen en contacto una vez finalizado el ensayo. terminado. Por lo general, compartirán sus resultados y proporcionarán otra información a su(s) médico(s) personal(es) si usted lo permite.
El equipo de estudio del ensayo clínico, que incluye médicos, enfermeras y otros profesionales de la salud, revisa la salud del participante en el
comienzo del ensayo, da instrucciones específicas para participar en el ensayo, supervisa al participante detenidamente durante el ensayo y se mantiene en contacto una vez finalizado el ensayo.
Algunos ensayos clínicos implican más pruebas y visitas al médico de las que normalmente tendría el participante por una enfermedad o afección. La participación en un ensayo clínico tiene más éxito cuando se sigue cuidadosamente el protocolo del estudio, incluido el contacto frecuente con el equipo del ensayo clínico.
Equipo de estudio de ensayos clínicos: Un equipo de ensayo clínico está formado por muchos miembros clave diferentes. El equipo puede variar según varios factores, incluidos el tipo y la fase del ensayo clínico y si el ensayo involucra varios centros. Los roles clave incluyen:
-
- Investigador Principal (IP): Un PI es el investigador principal o el médico que lleva a cabo el ensayo clínico. El IP es responsable de:
- Garantizar que se lleve a cabo una investigación de acuerdo con los investigador declaración, el plan de investigación y la normativa aplicable.
- Proteger los derechos, la seguridad y el bienestar de los sujetos bajo el cuidado del investigador.
- Control de la(s) terapia(s) bajo investigación.
- Coordinador de Investigaciones Clínicas (CRC): Un CRC gestiona y lleva a cabo las actividades de estudio del día a día de acuerdo con el protocolo, los reglamentos aplicables y Buena práctica clínica (GCP) y Junta de Revisión Institucional (IRB ) requisitos.
- Subinvestigador (Subyo): El Sub I es un miembro del equipo de investigación designado y supervisado por el PI para realizar procedimientos críticos relacionados con el estudio y/o para tomar decisiones importantes relacionadas con el estudio.
- Investigación Clínica Coordinadora de Enfermería (CRNC): Es posible que se requiera un CRNC para ciertas actividades relacionadas con el protocolo.
- Coordinador de Normatividad: El coordinador regulatorio prepara y mantiene las presentaciones del IRB y los documentos de la FDA. También puede realizar un seguimiento del progreso del estudio.
- Investigador Principal (IP): Un PI es el investigador principal o el médico que lleva a cabo el ensayo clínico. El IP es responsable de:
Una vez que se recopilan los datos del estudio, el equipo del ensayo clínico los analiza para identificar los hallazgos clave. El equipo usa estos hallazgos para determinar qué hacer a continuación con la terapia. El siguiente paso podría ser la siguiente fase de los ensayos clínicos si los datos parecen prometedores y la agencia reguladora está de acuerdo. Sin embargo, si la terapia no cumple con los estándares establecidos de seguridad y/o eficacia, no se realizarán más investigaciones.
¿Qué significa indicación y por qué es importante?
El "yondicacion" para fármaco se refiere al uso de ese fármaco para tratar una enfermedad/trastorno en particular. Un medicamento puede tener más de una indicación etiquetada por la FDA, lo que significa que puede usarse para múltiples afecciones médicas. La función principal del etiquetado de indicaciones es permitir que los profesionales de la salud identifiquen fácilmente las terapias apropiadas para los pacientes al comunicar claramente las indicaciones aprobadas del medicamento.
Uso fuera de etiqueta
Al analizar sus opciones de tratamiento, su proveedor de atención médica puede decidir que use un medicamento no indicado en la etiqueta de manera diferente a como se prescribe normalmente o para lo que está indicado. El uso fuera de etiqueta se define como el uso de un El medicamento aprobado por la FDA se usa de una manera que no ha sido aprobada por la FDA a través de un ensayo clínico estándar para seguridad y eficacia.
Los ejemplos de usos fuera de etiqueta pueden incluir, pero no se limitan a:
-
Cuando un medicamento se usa para una condición para la cual no está aprobado
-
Cuando un medicamento se dosifica de manera diferente a lo que ha sido aprobado
-
Tratar a niños con un medicamento que ha sido aprobado para su uso solo en adultos
Los usos fuera de etiqueta pueden eventualmente ser aprobados por la FDA.
Cobertura del seguro
Una indicacion también es importante en términos de seguros y facturación médica. Es posible que algunas pólizas de seguro médico no cubran el uso de medicamentos "no indicados en la etiqueta". La Parte D de Medicare cubre los medicamentos recetados para uso no autorizado solo si los medicamentos se identifican como seguros y efectivos para ese uso en uno de los tres compendios de medicamentos oficialmente reconocidos. Los “Compendios” son enciclopedias de fármacos químicos, con información sobre dosis y uso.
Sin duda, existen riesgos al inferir la indicación del diagnóstico, especialmente si el prescriptor está usando medicamentos para un propósito no indicado en la etiqueta.
¿Qué es un protocolo?
Un protocolo es un plan de estudio en el que se basa cada ensayo clínico. El plan está cuidadosamente diseñado para salvaguardar la salud de los participantes, así como
responder preguntas específicas de investigación. Un protocolo describe qué tipos de personas pueden participar en el ensayo; el cronograma de pruebas, procedimientos, medicamentos y dosis; y la duración del estudio.
¿Qué es un placebo?
Un placebo es una pastilla, líquido o polvo inactivo que no tiene valor de tratamiento. En los ensayos clínicos, los tratamientos del estudio a menudo se comparan con placebos para evaluar la eficacia del tratamiento del estudio. En algunos estudios, los participantes del grupo de control recibirán un placebo en lugar de un fármaco activo o un tratamiento experimental.
¿Qué es un grupo de control?
Un control es el estándar por el cual se evalúan las observaciones del estudio. En muchos ensayos clínicos, a un grupo de participantes del estudio se le administrará un fármaco o tratamiento en investigación (también llamado “estudio”), mientras que al grupo de control se le administrará un tratamiento estándar para la enfermedad o un placebo.
¿Puedo elegir en qué grupo participo? (Experimental o de control)
No, cada persona que acepta participar en un ensayo clínico que compara un medicamento o dispositivo de estudio con un tratamiento estándar o placebo es aleatoriamente
asignado (es decir, por casualidad) a uno de los grupos. En general, el participante y el equipo del ensayo clínico no conocen la asignación del grupo.
hasta que termine el estudio.
¿Qué diferencia hay si yo sé o el equipo clínico del ensayo sabe en qué grupo estoy?
El conocimiento de esta información puede influir en el informe de un participante o del equipo de estudio sobre cómo van las cosas en el estudio. Por ejemplo, si el
participante y/o el equipo de estudio sabe que el participante está en el grupo de estudio, un evento adverso, como una erupción cutánea, podría informarse como
“probablemente” relacionado con el fármaco del estudio, en lugar de “posiblemente relacionado”. O el participante podría informar eventos adversos con más frecuencia que si no estuviera al tanto de la asignación del grupo. Sin embargo, si el participante y/o el equipo del estudio saben que el participante está en el grupo de control/placebo, la erupción cutánea se informará como "no relacionada" y, lo que es más importante, el participante de este grupo podría informar involuntariamente un empeoramiento de su estado. enfermedad o condición, cuando no ha habido cambio.
¿Qué significa estudio simple ciego o doble ciego?
El “cegamiento” es un procedimiento en el que una o más personas en el ensayo de investigación no conocen la(s) asignación(es) de tratamiento. Simple ciego generalmente significa que al participante de la investigación no se le informa sobre la asignación del tratamiento. Doble ciego generalmente significa que el participante de la investigación, el investigador, el coordinador/enfermero del estudio, el patrocinador del estudio y, en algunos casos, el analista de datos no conocen la asignación del tratamiento. El propósito de un diseño de estudio "ciego" es eliminar el sesgo no intencional que puede afectar la interpretación de la información de investigación que se recopila, si se conoce la asignación del tratamiento. Si la seguridad del participante lo requiere, una Junta de Monitoreo de Seguridad de Datos independiente puede decirle rápidamente al investigador qué tratamiento se le asignó a un participante; sin embargo, esto generalmente requiere que el participante se retire de seguir participando en ese estudio.
¿Es lo mismo un efecto adverso que un efecto secundario?
No, estos dos términos no tienen el mismo significado. Un evento (o experiencia) adverso describe un evento o experiencia desfavorable que ocurre después de que un participante comienza el estudio de investigación. El evento o la experiencia puede ser informado por el participante de la investigación (como "Me sentí mareado todo el día") o observado por el investigador (como un resultado anormal de una prueba de laboratorio). La ocurrencia de una experiencia o evento desfavorable no significa necesariamente que esté asociado con (o causado por) el fármaco, dispositivo o tratamiento experimental. Generalmente, un evento/experiencia adverso se considera un “efecto secundario” cuando, una vez finalizado el estudio, se observó que el evento ocurre con mucha más frecuencia en los participantes que están en el grupo experimental que en el grupo de control.
Preguntas que hacer
Cualquier persona interesada en participar en un estudio clínico debe saber tanto como sea posible sobre el estudio y sentirse cómodo haciendo preguntas al equipo de investigación sobre el estudio, los procedimientos relacionados y cualquier gasto. Las siguientes preguntas pueden ser útiles durante dicha discusión. Las respuestas a algunas de estas preguntas se encuentran en el consentimiento informado documento. Muchas de las preguntas son específicas de los ensayos clínicos, pero algunas también se aplican a los estudios observacionales.
- ¿Qué se está estudiando?
- ¿Por qué los investigadores creen que la intervención que se está probando podría ser efectiva? ¿Por qué podría no ser efectivo? ¿Se ha probado antes?
- ¿Cuáles son las posibles intervenciones que podría recibir durante el ensayo?
- ¿Cómo se determinará qué intervenciones recibo (por ejemplo, por casualidad)?
- ¿Quién sabrá qué intervención recibo durante el ensayo? ¿Lo sabré? ¿Lo sabrán los miembros del equipo de investigación?
- ¿Cómo se comparan los posibles riesgos, efectos secundarios y beneficios de este ensayo con los de mi tratamiento actual?
- ¿Qué tendré que hacer?
- ¿Qué pruebas y procedimientos están involucrados?
- ¿Con qué frecuencia tendré que visitar el hospital o la clínica?
- ¿Será necesaria la hospitalización?
- ¿Cuánto durará el estudio?
- ¿Quién pagará mi participación?
- ¿Me reembolsarán otros gastos?
- ¿Qué tipo de atención de seguimiento a largo plazo forma parte de este ensayo?
- Si me beneficio de la intervención, ¿podré seguir recibiéndola después de que finalice el ensayo?
- ¿Se me proporcionarán los resultados del estudio?
- ¿Quién supervisará mi atención médica mientras participo en el ensayo?
- ¿Cuáles son mis opciones si me lesiono durante el estudio?

