Klinische Studien
Als Teil unserer Mission versucht die Dup15q Alliance, Familien, Forscher und Fachleute zusammenzubringen; und fördern Sie die Forschung, das Bewusstsein und stärken Sie Personen mit dup15q-Syndrom, indem Sie bahnbrechende Forschung und lebensverändernde therapeutische Behandlungen vorantreiben. Die Dup15q Alliance unterstützt und finanziert formell Forschung und arbeitet mit Forschern zusammen, die an der Erforschung von Chromosom-15q-Duplikationen interessiert sind, indem sie Forschungsinformationen verbreitet und Möglichkeiten für Dup15q Alliance-Familien fördert, an Forschungsstudien und Möglichkeiten für klinische Studien teilzunehmen.
Die Entscheidung, an einer klinischen Studie teilzunehmen, ist eine wichtige persönliche Entscheidung. Oft ist es hilfreich, mit einem Arzt, Familienmitgliedern oder Freunden über die Entscheidung zur Teilnahme an einer klinischen Studie zu sprechen.
Melden Sie sich für unsere NEUEN Textbenachrichtigungen zu Forschung und klinischen Studien an! Sie können sich jederzeit von Textbenachrichtigungen abmelden.
Verwenden Sie die diesen Link unter oder Senden Sie eine SMS mit „Warnungen“ an (847) 744-8904 sich anmelden!
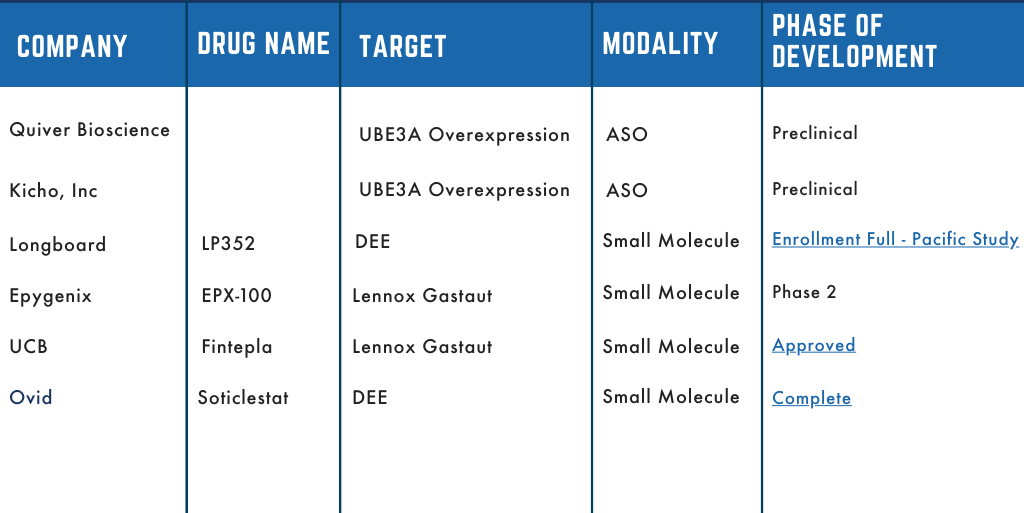
Dup15q Therapeutische Pipeline
Die Dup15q Alliance steht an vorderster Front der Zusammenarbeit mit Interessengruppen sowohl im akademischen als auch im pharmazeutischen Bereich. Wir haben uns zum Ziel gesetzt, die Forschungsanstrengungen zu beschleunigen, um therapeutische Interventionen für Menschen mit Dup15q zu entwickeln. Mehrere dieser Partnerschaften sind in die klinische Entwicklung übergegangen, und wir freuen uns, unsere Pipeline zu teilen. Die Pipeline beschreibt, welches Unternehmen das Therapeutikum entwickelt, den Namen des Wirkstoffs/Medikaments, worauf das Medikament abzielt und das Entwicklungsstadium.
Bleiben Sie auf dem Laufenden, während diese Medikamente die Entwicklung durchlaufen. Die Pipeline wird aktualisiert, um ihren Fortschrittsstand widerzuspiegeln.
Was ist eine klinische Studie?
Klinische Studien sind Forschungsstudien mit menschlichen Teilnehmern, die durchgeführt werden, um neue Behandlungen und Medikamente zu testen. Eine klinische Studie kann nur durchgeführt werden, wenn alle möglichen Vorkehrungen zum Schutz der Patientensicherheit getroffen wurden und wenn Grund zu der Annahme besteht, dass die neue Therapie die Versorgung, die Lebensqualität und andere Dinge verbessern wird. Alle klinischen Studien werden in Übereinstimmung mit den Grundsätzen der Guten Klinischen Praxis (GCP) durchgeführt, die von unabhängigen Ethikkommissionen (IEC und IRB) überwacht werden.
Was ist die Behandlung?
Neue Medikamente/Geräte werden zuerst als Behandlung durch umfangreiche Laborforschung getestet. Wenn die anfängliche Laborforschung erfolgreich ist, senden die Forscher die Daten an die Food and Drug Administration (FDA) zur Genehmigung, um die Forschung in klinischen Studien fortzusetzen.
Bereits vorhandene Medikamente/Geräte die für andere Diagnosen verwendet werden, werden häufig in klinischen Studien als potenzielle neue Behandlungsoption verwendet.
Warum an einer klinischen Studie teilnehmen?
Klinische Studien sind für jede neue Therapie vor der FDA-Zulassung erforderlich. Ohne freiwillige Teilnehmer wären wesentliche Verbesserungen in der Gesundheitsversorgung für seltene Erkrankungen wie das dup15q-Syndrom nicht möglich. Teilnehmer an klinischen Studien können eine aktivere Rolle in ihrer eigenen Gesundheitsversorgung spielen, Zugang zu neuen Forschungsbehandlungen erhalten, bevor sie allgemein verfügbar sind, und anderen helfen, indem sie zur medizinischen Forschung beitragen. Je mehr Menschen an klinischen Studien teilnehmen, desto schneller können Medikamente, Behandlungen und Änderungen des Lebensstils getestet werden und desto schneller können die Menschen besser versorgt werden.
Wie hilft die Teilnahme an einer klinischen Studie der Dup15q-Community?
Wir müssen eine bestimmte Anzahl von Patienten in der Dup15q-Gemeinschaft in Medikamentenstudien einschreiben, um sicherzustellen, dass es allen vom Dup15q-Syndrom Betroffenen zur Verfügung steht, wenn es auf den Markt kommt.
Wenn neue Behandlungen/Medikamente zur Behandlung von Störungen oder Symptomen von Störungen entwickelt werden, wählen die Entwickler Patientenpopulationen aus, um sich auf die Wirksamkeit und Wirksamkeit bei dieser bestimmten Störung zu konzentrieren. Wenn das Medikament in die nächsten Schritte der Zulassung dieser Störung und der Daten seiner Wirksamkeit geht geht in die Indikation ein (dass Erkrankungen ein Behandlungsgebiet für das Medikament sind).
Phasen einer klinischen Studie
Jede Phase ist darauf ausgelegt, bestimmte Fragen zu beantworten und gleichzeitig die Teilnehmer so sicher wie möglich zu halten. Die Ergebnisse dieser Phasen zeigen, ob das neue Medikament oder die Behandlung einigermaßen sicher und wirksam ist.
Phase 1
Ist es sicher für den Menschen?
Eine klinische Studie der Phase 1 testet zum ersten Mal eine potenzielle neue Behandlung an Menschen, manchmal auch als „First-in-Human-Studien“ bezeichnet. Das Hauptziel dieser Tests besteht darin, festzustellen, ob die Behandlung für den Menschen sicher ist.
- Wird mit gesunden Freiwilligen durchgeführt und betont die Sicherheit. Kann Patienten einschreiben, die die Krankheit haben.
- Informieren Sie sich über die häufigsten und schwerwiegendsten Nebenwirkungen der Therapie.
- Verstehen Sie, wie die Therapie metabolisiert und ausgeschieden wird.
- Bestimmen Sie die zu verabreichenden Sicherheitswerte
Phase 2
Ist es sicher und wirksam für die Zielkrankheit?
Ziel einer Phase-2-Studie ist es herauszufinden, ob die neue Therapie ihre Zielkrankheit sicher und wirksam behandelt. Die Daten werden für einige Monate bis 2 Jahre erhoben.
- Erfordert mehr Teilnehmer, und diese Teilnehmer müssen die Krankheit haben, die mit der neuen Therapie behandelt werden soll.
- Kontinuierliche Bewertung der Sicherheit und Überwachung kurzfristiger unerwünschter Ereignisse.
- Stellen Sie fest, ob die Therapie bei Menschen mit einer bestimmten Krankheit oder einem bestimmten Zustand wie erwartet wirkt.
- Kann Teilnehmer, die die Therapie erhalten, mit ähnlichen Teilnehmern vergleichen, die eine inaktive Substanz (sogenannte a Placebo).
Phase 3
Können die Ergebnisse der Phase 2 bestätigt werden?
Das Ziel von Phase-3-Studien ist es, die in Phase 2 gemachten Ergebnisse zu bestätigen oder zu widerlegen. Die Daten werden für 1 bis 4 Jahre gesammelt.
- Überwachen Sie kurz- und längerfristige Nebenwirkungen
- Stellen Sie fest, ob die Therapie bei einer größeren Patientengruppe weiterhin wie erwartet wirkt.
- Kann das Sammeln von Daten umfassen, um die wirksamste Dosierung zu bestimmen.
Phase 4
Funktioniert es in der „realen Welt“ wie erwartet?
Das Ziel dieser klinischen Phase-IV-Studien besteht darin, die Leistung der neuen Behandlung in der „realen Welt“ zu bewerten. Daten werden über viele Jahre gesammelt. Dies ist wichtig, da die neue Behandlung vor ihrer Zulassung nur in einem Studiensetting untersucht wurde.
- Auftreten, nachdem die FDA eine Therapie zur Vermarktung zugelassen hat.
- Sammeln Sie zusätzliche Informationen über die Sicherheit einer Therapie, Wirksamkeit, und optimale Nutzung.
- Nehmen Sie eine große Patientenpopulation auf, wobei die Zulassungsvoraussetzungen durch die von der FDA zugelassenen Indikationen bestimmt werden.
Häufig gestellte Fragen zu klinischen Studien
Die US National Library of Medicine unterhält eine Website, www.clinicaltrials.gov. Diese Website bietet einen kurzen Überblick über die klinische Forschung, Informationen für potenzielle Teilnehmer an klinischen Studien und ein Glossar mit gebräuchlichen Wörtern, die auf ClinicalTrials.gov verwendet werden.
Wer kann an einer klinischen Studie teilnehmen?
Jede klinische Studie hat ein Protokoll, das beschreibt, wer berechtigt ist, an der Forschung teilzunehmen. Jede Studie darf nur Personen umfassen, die die Anforderungen für diese Studie erfüllen. Dies sind die Zulassungskriterien der Studie.
Die Zulassungskriterien sind für jede Studie unterschiedlich. Diese Kriterien basieren auf den Zielen der Studie und werden verwendet, um geeignete Teilnehmer zu identifizieren, sie zu schützen und sicherzustellen, dass Forscher die neuen Informationen finden, die sie benötigen. Dazu gehören Faktoren wie Alter, Art und Stadium einer Erkrankung, Vorbehandlungen und andere Erkrankungen.
Warum an einer klinischen Studie teilnehmen?
Klinische Studien sind für jede neue Therapie vor der FDA-Zulassung erforderlich. Ohne freiwillige Teilnehmer wären wesentliche Verbesserungen in der Gesundheitsversorgung für seltene Erkrankungen wie das dup15q-Syndrom nicht möglich.
Teilnehmer an klinischen Studien können eine aktivere Rolle in ihrer eigenen Gesundheitsversorgung spielen, Zugang zu neuen Forschungsbehandlungen erhalten, bevor sie allgemein verfügbar sind, und anderen helfen, indem sie zur medizinischen Forschung beitragen.
Je mehr Menschen an klinischen Studien teilnehmen, desto schneller können Medikamente, Behandlungen und Änderungen des Lebensstils getestet werden und desto schneller können die Menschen besser versorgt werden. Klinische Studien haben viele potenzielle medizinische Vorteile, darunter:
- Identifizierung wirksamer Behandlungen für zukünftige Generationen
- Beschleunigung der Forschung für neue und innovative Behandlungen
- Senkung der Therapiekosten durch ein besseres Verständnis dafür, welche Patienten von einer bestimmten Therapieform profitieren können
- Bereitstellung vollständigerer Daten für Forscher
Was sind die Risiken?
Eine klinische Studie kann nur durchgeführt werden, wenn alle möglichen Vorkehrungen zum Schutz der Patientensicherheit getroffen wurden, und ein Prüfpräparat kann nur getestet werden, wenn eine echte Möglichkeit eines therapeutischen Nutzens besteht. Alle klinischen Studien werden in Übereinstimmung mit den Grundsätzen der Guten Klinischen Praxis (GCP) durchgeführt, die von unabhängigen Ethikkommissionen (IEC und IRB) überwacht werden.
- Der Arzt, der eine klinische Studie durchführt, stellt sicher, dass jeder Patient, der zur Teilnahme eingeladen wird, Informationen über mögliche unerwünschte Ereignisse erhält und Zeit hat, die Risiken abzuwägen.
- Die Patienten erhalten Zeit zum Nachdenken, bevor sie sich entscheiden, ob sie an einer Studie teilnehmen möchten. Wenn sie sich zur Teilnahme entschließen, werden sie durch die Risiken geführt und gebeten, zu bestätigen, dass sie sich der Studienverfahren, Risiken und Einschränkungen bewusst sind.
- Patienten, die an klinischen Studien teilnehmen, genießen während der gesamten Studie den höchsten Schutz durch biologische, medizinische und klinische Überwachung.
- Patienten können jederzeit entscheiden, aus der Studie auszuscheiden.
Wie hilft die Teilnahme anderen in der dup15q-Community?
Wir müssen eine bestimmte Anzahl von Patienten in der Dup15q-Gemeinschaft in Medikamentenstudien einschreiben, um sicherzustellen, dass es allen vom Dup15q-Syndrom Betroffenen zur Verfügung steht, wenn es auf den Markt kommt.
Wenn neue Behandlungen/Medikamente zur Behandlung von Störungen oder Symptomen von Störungen entwickelt werden, wählen die Entwickler Patientenpopulationen aus, um sich auf die Wirksamkeit und Wirksamkeit bei dieser bestimmten Störung zu konzentrieren. Wenn das Medikament in die nächsten Schritte der Zulassung dieser Störung und der Daten seiner Wirksamkeit geht geht in die Indikation ein (dass Erkrankungen ein Behandlungsgebiet für das Medikament sind)
Was passiert während der klinischen Studie?
Bevor jemand in irgendeiner Phase als Teilnehmer an einer Studie teilnimmt, treffen Sie sich mit den Forschern, die die Studie durchführen, um relevante Aspekte der Studie zu besprechen und die Einverständniserklärung durchzugehen. Insbesondere unterscheidet sich jede Studie in Bezug darauf, wer teilnehmen kann, wie viele Teilnehmer benötigt werden, welche Tests verwendet werden, wie lange die Studie dauert und wie die Daten analysiert werden.
Es wird auch in Bezug auf die Zeit, das Geld und die Energie variieren, die Sie und Ihre Familie benötigen, wenn Sie sich für eine Teilnahme entscheiden. Sie sollten den Forschern, die die Studie durchführen, möglichst viele Fragen stellen, um die Informationen zu erhalten, die Sie benötigen, um zu entscheiden, ob die Teilnahme für Sie und Ihre Familie richtig ist.
Während der klinischen Studie Ihr Studienteam für die klinische Studie, zu dem Ärzte, Krankenschwestern und andere Angehörige der Gesundheitsberufe gehören, die Ihre Gesundheitsversorgung gewährleisten. Sie überprüfen den Gesundheitszustand des Teilnehmers zu Beginn der Studie, geben spezifische Anweisungen für die Teilnahme an der Studie, führen die Tests und Untersuchungen im Zusammenhang mit der Studie durch, überwachen den Teilnehmer sorgfältig während der Studie und bleiben nach Abschluss der Studie in Kontakt abgeschlossen. Sie teilen normalerweise Ihre Ergebnisse und geben Ihrem/Ihren persönlichen Arzt(en) weitere Informationen, wenn Sie dies zulassen.
Das Studienteam der klinischen Studie, dem Ärzte, Krankenschwestern und andere Angehörige der Gesundheitsberufe angehören, überprüft die Gesundheit des Teilnehmers an der
Beginn der Studie, gibt spezifische Anweisungen für die Teilnahme an der Studie, überwacht den Teilnehmer während der Studie sorgfältig und bleibt nach Abschluss der Studie in Kontakt.
Einige klinische Studien beinhalten mehr Tests und Arztbesuche, als der Teilnehmer normalerweise für eine Krankheit oder einen Zustand hätte. Die Teilnahme an klinischen Studien ist am erfolgreichsten, wenn das Studienprotokoll sorgfältig befolgt wird, einschließlich häufigem Kontakt mit dem Team der klinischen Studie.
Studienteam für klinische Studien: Ein klinisches Studienteam besteht aus vielen verschiedenen wichtigen Mitgliedern. Das Team kann je nach mehreren Faktoren variieren, einschließlich der Art und Phase der klinischen Studie und ob die Studie mehrere Zentren umfasst. Zu den Schlüsselrollen gehören:
-
- Hauptuntersuchungsleiter (PI): Ein PI ist der leitende Forscher oder Kliniker, der die klinische Studie durchführt. Der PI ist verantwortlich für:
- Sicherstellen, dass eine Untersuchung gemäß der Unterzeichnung durchgeführt wird Ermittler Erklärung, den Untersuchungsplan und geltende Vorschriften.
- Schutz der Rechte, der Sicherheit und des Wohlergehens der Probanden unter der Obhut des Ermittlers.
- Kontrolle der untersuchten Therapie(n).
- Klinischer Forschungskoordinator (CRC): Ein CRC verwaltet und führt die täglichen Studienaktivitäten in Übereinstimmung mit dem Protokoll, den geltenden Vorschriften und durch Gute klinische Praxis (GCP) und Institutionelle Prüfungskommission (IRB ) Anforderungen.
- Unterermittler (Teil I): Der Sub I ist ein Mitglied des Forschungsteams, das vom PI benannt und beaufsichtigt wird, um kritische studienbezogene Verfahren durchzuführen und/oder wichtige studienbezogene Entscheidungen zu treffen.
- Klinische Forschung Pflegekoordinator (CRNC): Für bestimmte protokollbezogene Aktivitäten kann ein CRNC erforderlich sein.
- Regulatorischer Koordinator: Der Regulierungskoordinator erstellt und pflegt IRB-Einreichungen und FDA-Dokumente. Kann auch den Studienfortschritt verfolgen.
- Hauptuntersuchungsleiter (PI): Ein PI ist der leitende Forscher oder Kliniker, der die klinische Studie durchführt. Der PI ist verantwortlich für:
Nachdem die Daten aus der Studie gesammelt wurden, analysiert das klinische Studienteam sie, um die wichtigsten Ergebnisse zu identifizieren. Das Team verwendet diese Erkenntnisse, um zu bestimmen, was als nächstes mit der Therapie zu tun ist. Der nächste Schritt könnte die nächste Phase der klinischen Studien sein, wenn die Daten vielversprechend aussehen und die Zulassungsbehörde zustimmt. Erfüllt die Therapie jedoch nicht die festgelegten Sicherheits- und/oder Wirksamkeitsstandards, werden keine weiteren Untersuchungen durchgeführt.
Was bedeutet Anzeige und warum ist sie wichtig?
Das iVerzicht" Für ein Medikament bezieht sich auf die Verwendung dieses Medikaments zur Behandlung einer bestimmten Krankheit/Störung. Ein Medikament kann mehr als eine von der FDA gekennzeichnete Indikation haben, was bedeutet, dass es für mehrere Erkrankungen verwendet werden kann. Die primäre Aufgabe der Indikationskennzeichnung besteht darin, medizinisches Fachpersonal in die Lage zu versetzen, geeignete Therapien für Patienten leicht zu identifizieren, indem die zugelassene(n) Indikation(en) des Arzneimittels klar kommuniziert werden.
Off-Label-Verwendung
Bei der Prüfung Ihrer Behandlungsoptionen kann Ihr Arzt entscheiden, dass Sie ein Off-Label-Medikament anders anwenden, als es normalerweise verschrieben wird oder wofür es angezeigt ist. Off-Label-Use ist definiert als die Verwendung eines Von der FDA zugelassene Medikamente werden auf eine Weise verwendet, die nicht von der FDA zugelassen wurde durch a Klinische Standardstudie für Sicherheit und Wirksamkeit.
Beispiele für Off-Label-Uses können unter anderem sein:
-
Wenn ein Medikament für eine Erkrankung verwendet wird, für deren Behandlung es nicht zugelassen ist
-
Wenn ein Medikament anders dosiert wird als zugelassen
-
Behandlung von Kindern mit einem Medikament, das nur für Erwachsene zugelassen ist
Off-Label-Uses können schließlich von der FDA zugelassen werden.
Versicherungsschutz
Ein Indiz ist auch in Bezug auf Versicherung und medizinische Abrechnung wichtig. Einige Krankenversicherungspolicen decken den „Off-Label“-Einsatz von Medikamenten möglicherweise nicht ab. Medicare Teil D deckt Medikamente ab, die für den Off-Label-Use verschrieben werden, nur wenn die Medikamente in einem von drei offiziell anerkannten Arzneimittelkompendien als sicher und wirksam für diesen Gebrauch identifiziert wurden. „Kompendien“ sind Enzyklopädien von Arzneimittelchemikalien mit Informationen zu Dosierung und Anwendung.
Es birgt sicherlich Risiken, aus der Diagnose auf eine Indikation zu schließen, insbesondere wenn der verschreibende Arzt das Medikament zu Off-Label-Zwecken einsetzt.
Was ist ein Protokoll?
Ein Protokoll ist ein Studienplan, auf dem jede klinische Studie basiert. Der Plan ist sorgfältig entworfen, um die Gesundheit der Teilnehmer sowie zu schützen
konkrete Forschungsfragen beantworten. Ein Protokoll beschreibt, welche Arten von Personen an der Studie teilnehmen können; der Zeitplan für Tests, Verfahren, Medikamente und Dosierungen; und die Dauer des Studiums.
Was ist ein Placebo?
Ein Placebo ist eine inaktive Pille, Flüssigkeit oder ein Pulver, das keinen Behandlungswert hat. In klinischen Studien werden Studienbehandlungen häufig mit Placebos verglichen, um die Wirksamkeit der Studienbehandlung zu beurteilen. In einigen Studien erhalten die Teilnehmer der Kontrollgruppe ein Placebo anstelle eines Wirkstoffs oder einer experimentellen Behandlung.
Was ist eine Kontrollgruppe?
Eine Kontrolle ist der Standard, nach dem Studienbeobachtungen bewertet werden. In vielen klinischen Studien erhält eine Gruppe von Studienteilnehmern ein Prüfpräparat (auch als „Studie“ bezeichnet) oder eine Behandlung, während die Kontrollgruppe entweder eine Standardbehandlung für die Krankheit oder ein Placebo erhält.
Kann ich mir aussuchen, an welcher Gruppe ich teilnehme? (Experimentell oder Kontrolle)
Nein, jede Person, die sich bereit erklärt, an einer klinischen Studie teilzunehmen, die ein Studienmedikament oder -gerät mit einer Standardbehandlung oder einem Placebo vergleicht, erfolgt nach dem Zufallsprinzip
(d. h. zufällig) einer der Gruppen zugeordnet. Im Allgemeinen kennen der Teilnehmer und das klinische Studienteam die Gruppenzuordnung nicht
bis nach Abschluss des Studiums.
Welchen Unterschied macht es, wenn ich weiß oder das Studienteam des klinischen Teams weiß, zu welcher Gruppe ich gehöre?
Die Kenntnis dieser Informationen kann die Berichterstattung eines Teilnehmers oder eines Studienteams über den Verlauf der Studie beeinflussen. Wenn zum Beispiel die
Wenn der Teilnehmer und/oder das Studienteam weiß, dass der Teilnehmer in der Studiengruppe ist, kann ein unerwünschtes Ereignis wie Hautausschlag gemeldet werden
„wahrscheinlich“ im Zusammenhang mit dem Studienmedikament statt „möglicherweise im Zusammenhang“. Oder der Teilnehmer berichtet möglicherweise häufiger über unerwünschte Ereignisse, als wenn ihm die Gruppenzuordnung nicht bekannt wäre. Wenn der Teilnehmer und/oder das Studienteam jedoch weiß, dass der Teilnehmer in der Kontroll-/Placebogruppe ist, wird der Hautausschlag als „nicht zusammenhängend“ gemeldet und, was noch wichtiger ist, der Teilnehmer in dieser Gruppe könnte unbeabsichtigt eine Verschlechterung seines Zustands melden Krankheit oder Zustand, wenn keine Veränderung eingetreten ist.
Was bedeutet Einfachblind- oder Doppelblindstudie?
„Blindung“ ist ein Verfahren, bei dem eine oder mehrere Personen in der Forschungsstudie über die Behandlungsaufgabe(n) nicht informiert werden. Einfachblind bedeutet in der Regel, dass dem Forschungsteilnehmer der Behandlungsauftrag nicht mitgeteilt wird. Doppelblind bedeutet in der Regel, dass der Forschungsteilnehmer, der Prüfer, der Studienkoordinator/die Krankenschwester, der Studiensponsor und in einigen Fällen der Datenanalyst über den Behandlungsauftrag nicht informiert werden. Der Zweck eines „verblindeten“ Studiendesigns besteht darin, die unbeabsichtigte Verzerrung zu beseitigen, die die Interpretation der gesammelten Forschungsinformationen beeinträchtigen kann, wenn der Behandlungsauftrag bekannt ist. Wenn es die Sicherheit des Teilnehmers erfordert, kann ein unabhängiges Data Safety Monitoring Board dem Prüfarzt schnell mitteilen, welcher Behandlungsauftrag einem Teilnehmer erteilt wurde; Dies erfordert jedoch in der Regel, dass der Teilnehmer von der weiteren Teilnahme an dieser Studie zurücktritt.
Ist eine Nebenwirkung dasselbe wie eine Nebenwirkung?
Nein, diese beiden Begriffe haben nicht die gleiche Bedeutung. Ein unerwünschtes Ereignis (oder eine unerwünschte Erfahrung) beschreibt ein ungünstiges Ereignis oder eine ungünstige Erfahrung, die auftritt, nachdem ein Teilnehmer die Forschungsstudie begonnen hat. Das Ereignis oder die Erfahrung kann vom Forschungsteilnehmer gemeldet (z. B. „Mir war den ganzen Tag schwindelig“) oder vom Forscher beobachtet werden (z. B. ein anormales Labortestergebnis). Das Auftreten einer ungünstigen Erfahrung oder eines ungünstigen Ereignisses bedeutet nicht unbedingt, dass es mit dem experimentellen Medikament, Gerät oder der Behandlung in Zusammenhang steht (oder durch dieses verursacht wird). Im Allgemeinen wird ein unerwünschtes Ereignis/Erfahrung als „Nebenwirkung“ angesehen, wenn nach Abschluss der Studie beobachtet wurde, dass das Ereignis bei Teilnehmern der Versuchsgruppe viel häufiger auftritt als in der Kontrollgruppe.
Zu stellende Fragen
Jeder, der an einer Teilnahme an einer klinischen Studie interessiert ist, sollte so viel wie möglich über die Studie wissen und sich wohl fühlen, dem Forschungsteam Fragen zur Studie, den damit verbundenen Verfahren und etwaigen Kosten zu stellen. Die folgenden Fragen können während einer solchen Diskussion hilfreich sein. Antworten auf einige dieser Fragen finden Sie in der Einverständniserklärung dokumentieren. Viele der Fragen sind spezifisch für klinische Studien, einige gelten jedoch auch für Beobachtungsstudien.
- Was wird studiert?
- Warum glauben die Forscher, dass die getestete Intervention wirksam sein könnte? Warum könnte es nicht wirksam sein? Wurde es vorher getestet?
- Was sind die möglichen Interventionen, die ich während der Studie erhalten könnte?
- Wie wird festgestellt, welche Eingriffe ich erhalte (z. B. zufällig)?
- Wer erfährt, welche Intervention ich während der Studie erhalte? Werde ich es wissen? Werden die Mitglieder des Forschungsteams davon erfahren?
- Wie sind die möglichen Risiken, Nebenwirkungen und Vorteile dieser Studie im Vergleich zu denen meiner derzeitigen Behandlung?
- Was werde ich zu tun haben?
- Welche Tests und Verfahren sind beteiligt?
- Wie oft muss ich das Krankenhaus oder die Klinik aufsuchen?
- Wird ein Krankenhausaufenthalt erforderlich sein?
- Wie lange wird das Studium dauern?
- Wer bezahlt meine Teilnahme?
- Werden mir weitere Kosten erstattet?
- Welche Art der langfristigen Nachsorge ist Teil dieser Studie?
- Wenn ich von der Intervention profitiere, darf ich sie auch nach Ende der Studie erhalten?
- Werden mir die Ergebnisse der Studie zur Verfügung gestellt?
- Wer überwacht meine medizinische Versorgung, während ich an der Studie teilnehme?
- Welche Möglichkeiten habe ich, wenn ich mich während der Studie verletze?

