Clinical Trials
Als onderdeel van onze missie streeft de Dup15q Alliance ernaar families, onderzoekers en professionals te verenigen; en het bevorderen van onderzoek, bewustwording en empowerment van individuen met het dup15q-syndroom door baanbrekend onderzoek en levensveranderende therapeutische behandelingen te bevorderen. Dup15q Alliance onderschrijft en financiert formeel onderzoek en werkt samen met onderzoekers die geïnteresseerd zijn in onderzoek naar chromosoom 15q-duplicaties door onderzoeksinformatie te verspreiden en kansen voor Dup15q Alliance-families te promoten om deel te nemen aan onderzoeksstudies en klinische proefmogelijkheden.
De keuze om deel te nemen aan een klinische proef is een belangrijke persoonlijke beslissing. Het is vaak nuttig om met een arts, familieleden of vrienden te praten over de beslissing om deel te nemen aan een klinische proef.
Meld u aan voor onze NIEUWE tekstwaarschuwingen voor onderzoek en klinische proeven! U kunt zich op elk moment afmelden voor sms-meldingen.
Te gebruiken deze link onder of Sms "Alerts" naar (847) 744-8904 inschrijven!
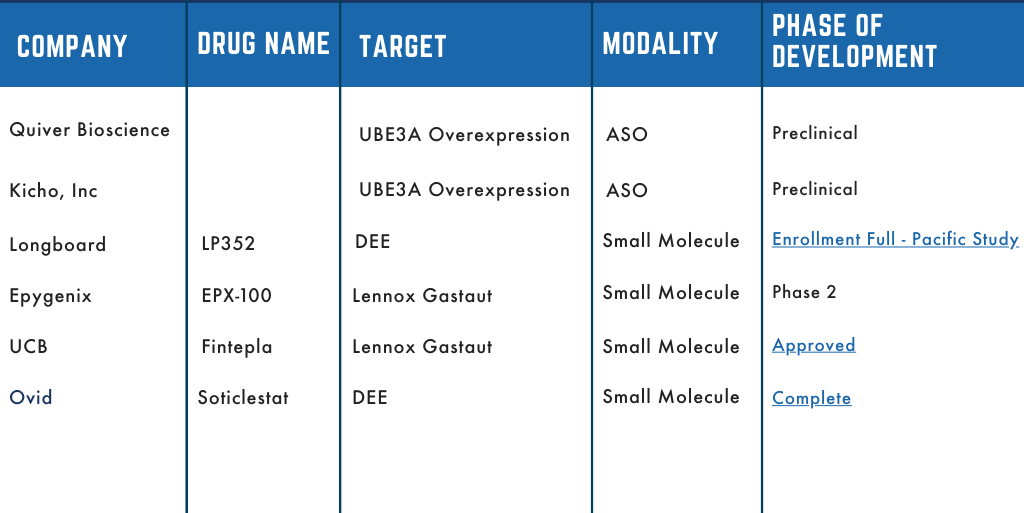
Dup15q therapeutische pijplijn
De Dup15q Alliance loopt voorop in samenwerking met belanghebbenden in zowel de academische als de farmaceutische sector. We hebben ernaar gestreefd de onderzoeksinspanningen te versnellen om therapeutische interventies te ontwikkelen voor mensen met Dup15q. Verschillende van die partnerschappen zijn overgegaan naar klinische ontwikkeling en we zijn verheugd om onze pijplijn te delen. De pijplijn schetst welk bedrijf het geneesmiddel ontwikkelt, de naam van het activum/medicijn, waar het medicijn op gericht is en het ontwikkelingsstadium.
Blijf op de hoogte terwijl deze medicijnen door de ontwikkeling gaan, de pijplijn zal worden bijgewerkt om hun voortgangsstadium weer te geven.
Wat is een klinische proef?
Klinische onderzoeken zijn onderzoeksstudies waarbij menselijke deelnemers betrokken zijn en die worden uitgevoerd om nieuwe behandelingen en medicijnen te testen. Een klinische proef kan alleen worden uitgevoerd als alle mogelijke voorzorgsmaatregelen zijn genomen om de veiligheid van de patiënt te beschermen en als er reden is om aan te nemen dat de nieuwe therapie de zorg, de kwaliteit van leven en andere zaken zal verbeteren. Alle klinische onderzoeken worden uitgevoerd in overeenstemming met de Principles of Good Clinical Practice (GCP), die onder toezicht staan van onafhankelijke ethische commissies (IEC en IRB).
Wat is de behandeling?
Nieuwe medicijnen/apparaten worden eerst als behandeling getest via uitgebreid laboratoriumonderzoek. Als het eerste laboratoriumonderzoek succesvol is, sturen de onderzoekers de gegevens naar de Food and Drug Administration (FDA) ter goedkeuring om het onderzoek in klinische proeven voort te zetten.
Reeds bestaande medicijnen/apparaten die voor andere diagnoses worden gebruikt, worden vaak in klinische onderzoeken gebruikt als een mogelijke nieuwe behandelingsoptie.
Waarom deelnemen aan een klinische studie?
Klinische proeven zijn vereist voor elke nieuwe therapie voorafgaand aan goedkeuring door de FDA. Grote verbeteringen in de gezondheidszorg voor zeldzame aandoeningen zoals het dup15q-syndroom zouden onmogelijk zijn zonder vrijwillige deelnemers. Deelnemers aan klinische onderzoeken kunnen een actievere rol spelen in hun eigen gezondheidszorg, toegang krijgen tot nieuwe onderzoeksbehandelingen voordat deze algemeen beschikbaar zijn, en anderen helpen door bij te dragen aan medisch onderzoek. Hoe meer mensen deelnemen aan klinische onderzoeken, hoe sneller medicijnen, behandelingen en veranderingen in levensstijl kunnen worden getest en hoe sneller mensen betere zorg kunnen krijgen.
Hoe helpt deelname aan een klinische proef de Dup15q-gemeenschap?
We moeten een bepaald aantal patiënten in de Dup15q-gemeenschap hebben ingeschreven voor geneesmiddelenonderzoeken om ervoor te zorgen dat het beschikbaar is voor iedereen die aan het Dup15q-syndroom lijdt wanneer het op de markt komt.
Wanneer nieuwe behandelingen/geneesmiddelen worden ontwikkeld om aandoeningen of symptomen van aandoeningen aan te pakken, kiezen de ontwikkelaars patiëntenpopulaties om zich te concentreren op de werkzaamheid en effectiviteit bij die specifieke aandoening, dus wanneer het medicijn de volgende stappen van goedkeuring van die aandoening en de gegevens over de effectiviteit ervan doorgaat gaat in op de indicatie (dat aandoeningen worden vermeld als behandelgebied voor het middel).
Fasen van een klinische proef
Elke fase is ontworpen om bepaalde vragen te beantwoorden en tegelijkertijd de deelnemers zo veilig mogelijk te houden. Resultaten van deze fasen laten zien of het nieuwe medicijn of de nieuwe behandeling redelijk veilig en effectief is.
Fase 1
Is het veilig voor mensen?
Een fase 1-klinische studie test voor de eerste keer een mogelijke nieuwe behandeling bij mensen, ook wel 'first-in-human studies' genoemd. Het primaire doel van deze testen is om te bepalen of de behandeling veilig is voor mensen.
- Uitgevoerd met gezonde vrijwilligers en nadruk op veiligheid. Kan patiënten inschrijven die de ziekte hebben.
- Ontdek wat de meest voorkomende en ernstige bijwerkingen van de therapie zijn.
- Begrijp hoe de therapie wordt gemetaboliseerd en uitgescheiden.
- Bepaal veilige niveaus die moeten worden toegediend
Fase 2
Is het veilig en effectief voor de doelziekte?
Het doel van een fase 2-studie is om uit te zoeken of de nieuwe therapie de beoogde ziekte veilig en effectief behandelt. Gegevens worden verzameld voor enkele maanden tot 2 jaar.
- Vereist meer deelnemers, en deze deelnemers moeten de ziekte hebben waarvoor de nieuwe therapie bedoeld is.
- Voortdurende evaluatie van de veiligheid en monitoring van bijwerkingen op korte termijn.
- Bepaal of de therapie werkt zoals verwacht bij mensen met een bepaalde ziekte of aandoening.
- Kan deelnemers die de therapie krijgen vergelijken met vergelijkbare deelnemers die een inactieve stof krijgen (genaamd a placebo).
Fase 3
Kunnen de bevindingen van fase 2 worden bevestigd?
Het doel van fase 3-onderzoeken is om de bevindingen van fase 2 te bevestigen of te ontkrachten. De gegevens worden gedurende 1 tot 4 jaar verzameld.
- Monitor bijwerkingen op korte en langere termijn
- Bepaal of de therapie bij een grotere groep patiënten blijft werken zoals verwacht.
- Kan het verzamelen van gegevens omvatten om de meest effectieve dosering te bepalen.
Fase 4
Presteert het zoals verwacht in de "echte wereld"?
Het doel van deze klinische fase IV-onderzoeken is om de prestaties van de nieuwe behandeling in de 'echte wereld' te beoordelen. Gegevens worden voor vele jaren verzameld. Dit is belangrijk omdat de nieuwe behandeling voorafgaand aan de goedkeuring ervan alleen in een studiesetting is onderzocht.
- Treedt op nadat de FDA een therapie voor marketing heeft goedgekeurd.
- Verzamel aanvullende informatie over de veiligheid van een therapie, werkzaamheiden optimaal gebruik.
- Schrijf een grote patiëntenpopulatie in, waarbij de geschiktheidsvereisten worden bepaald door de door de FDA goedgekeurde indicaties.
Veelgestelde vragen over klinische proeven
De Amerikaanse National Library of Medicine onderhoudt een website, www.clinicaltrials.gov. Deze website biedt een kort overzicht van klinisch onderzoek, informatie voor potentiële deelnemers aan klinische onderzoeken en een woordenlijst van veelgebruikte woorden op ClinicalTrials.gov.
Wie kan deelnemen aan een klinische proef?
Elke klinische studie heeft een protocol dat beschrijft wie in aanmerking komt voor deelname aan het onderzoek. Elke studie mag alleen mensen omvatten die voldoen aan de vereisten voor die studie. Dit zijn de geschiktheidscriteria van het onderzoek.
De geschiktheidscriteria zijn voor elke proef verschillend. Deze criteria zijn gebaseerd op de doelstellingen van het onderzoek en worden gebruikt om geschikte deelnemers te identificeren, ze veilig te houden en ervoor te zorgen dat onderzoekers de nieuwe informatie kunnen vinden die ze nodig hebben. Ze omvatten factoren als leeftijd, het type en stadium van een ziekte, eerdere behandelingsgeschiedenis en andere medische aandoeningen.
Waarom deelnemen aan een klinische studie?
Klinische proeven zijn vereist voor elke nieuwe therapie voorafgaand aan goedkeuring door de FDA. Grote verbeteringen in de gezondheidszorg voor zeldzame aandoeningen zoals het dup15q-syndroom zouden onmogelijk zijn zonder vrijwillige deelnemers.
Deelnemers aan klinische onderzoeken kunnen een actievere rol spelen in hun eigen gezondheidszorg, toegang krijgen tot nieuwe onderzoeksbehandelingen voordat deze algemeen beschikbaar zijn, en anderen helpen door bij te dragen aan medisch onderzoek.
Hoe meer mensen deelnemen aan klinische onderzoeken, hoe sneller medicijnen, behandelingen en veranderingen in levensstijl kunnen worden getest en hoe sneller mensen betere zorg kunnen krijgen. Klinische onderzoeken hebben veel potentiële medische voordelen, waaronder:
- Effectieve behandelingen voor toekomstige generaties identificeren
- Onderzoek naar nieuwe en innovatieve behandelingen versnellen
- De kosten van therapie verlagen door beter inzicht te krijgen in welke patiënten baat kunnen hebben bij een specifiek type therapie
- Onderzoekers completere gegevens geven
Wat zijn de risico's?
Een klinische proef kan alleen worden uitgevoerd als alle mogelijke voorzorgsmaatregelen zijn genomen om de veiligheid van de patiënt te beschermen, en een onderzoeksgeneesmiddel kan alleen worden getest als er een reële mogelijkheid van therapeutisch voordeel is. Alle klinische onderzoeken worden uitgevoerd in overeenstemming met de Principles of Good Clinical Practice (GCP), die onder toezicht staan van onafhankelijke ethische commissies (IEC en IRB).
- De arts die een klinische studie uitvoert, zal ervoor zorgen dat elke patiënt die wordt uitgenodigd om deel te nemen, wordt voorzien van informatie over mogelijke bijwerkingen en tijd heeft om de risico's te overwegen.
- Patiënten krijgen de tijd om na te denken voordat ze beslissen of ze aan een studie willen deelnemen. Als ze besluiten deel te nemen, worden ze door de risico's geleid en wordt hen gevraagd te bevestigen dat ze op de hoogte zijn van de studieprocedures, risico's en beperkingen.
- Patiënten die deelnemen aan klinische onderzoeken krijgen tijdens het onderzoek de hoogste mate van bescherming door middel van biologisch, medisch en klinisch toezicht.
- Patiënten kunnen op elk moment besluiten zich uit het onderzoek terug te trekken.
Hoe helpt deelname anderen in de dup15q-gemeenschap?
We moeten een bepaald aantal patiënten in de Dup15q-gemeenschap hebben ingeschreven voor geneesmiddelenonderzoeken om ervoor te zorgen dat het beschikbaar is voor iedereen die aan het Dup15q-syndroom lijdt wanneer het op de markt komt.
Wanneer nieuwe behandelingen/geneesmiddelen worden ontwikkeld om aandoeningen of symptomen van aandoeningen aan te pakken, kiezen de ontwikkelaars patiëntenpopulaties om zich te concentreren op de werkzaamheid en effectiviteit bij die specifieke aandoening, dus wanneer het medicijn de volgende stappen van goedkeuring van die aandoening en de gegevens over de effectiviteit ervan doorgaat gaat in op de indicatie (dat aandoeningen worden vermeld als behandelgebied voor het middel)
Wat gebeurt er tijdens de klinische proef?
Voordat iemand als deelnemer deelneemt aan een studie, in welke fase dan ook, heb je een ontmoeting met de onderzoekers die de studie uitvoeren om relevante aspecten van de studie te bespreken en het formulier voor geïnformeerde toestemming door te nemen. In het bijzonder zal elk onderzoek verschillen in termen van wie kan deelnemen, hoeveel deelnemers nodig zijn, welke tests zullen worden gebruikt, hoe lang het onderzoek zal duren en hoe de gegevens zullen worden geanalyseerd.
Het zal ook variëren in termen van tijd, geld en energie die van u en uw gezin nodig zijn als u ervoor kiest om deel te nemen. U moet zoveel mogelijk vragen stellen aan de onderzoekers die het onderzoek uitvoeren om de informatie te krijgen die u nodig hebt om te beslissen of deelname geschikt is voor u en uw gezin.
Tijdens de klinische proef, uw onderzoeksteam voor klinische proeven, dat bestaat uit artsen, verpleegkundigen en andere beroepsbeoefenaren in de gezondheidszorg die uw zorg zullen verlenen. Zij controleren de gezondheid van de deelnemer aan het begin van het onderzoek, geven specifieke instructies voor deelname aan het onderzoek, doen de testen en examens die verband houden met het onderzoek, volgen de deelnemer zorgvuldig tijdens het onderzoek en houden contact na afloop van het onderzoek voltooid. Ze zullen gewoonlijk uw resultaten delen en andere informatie verstrekken aan uw persoonlijke arts(en) als u dat toestaat.
Het onderzoeksteam voor klinische proeven, dat bestaat uit artsen, verpleegkundigen en andere beroepsbeoefenaren in de gezondheidszorg, controleert de gezondheid van de deelnemer aan de
aan het begin van het onderzoek, geeft specifieke instructies voor deelname aan het onderzoek, volgt de deelnemer zorgvuldig tijdens het onderzoek en houdt contact nadat het onderzoek is afgerond.
Sommige klinische onderzoeken omvatten meer tests en doktersbezoeken dan de deelnemer normaal zou hebben voor een ziekte of aandoening. Deelname aan klinische onderzoeken is het meest succesvol wanneer het onderzoeksprotocol zorgvuldig wordt gevolgd, inclusief frequent contact met het klinische onderzoeksteam.
Onderzoeksteam voor klinische proeven: Een klinisch onderzoeksteam bestaat uit veel verschillende belangrijke leden. Het team kan variëren afhankelijk van verschillende factoren, waaronder het type en de fase van de klinische proef en of bij de proef meerdere centra betrokken zijn. Sleutelrollen zijn onder meer:
-
- Hoofdonderzoeker (PI): Een PI is de hoofdonderzoeker of clinicus die de klinische proef uitvoert. De PI is verantwoordelijk voor:
- Ervoor zorgen dat een onderzoek wordt uitgevoerd volgens de ondertekende onderzoeker verklaring, het onderzoeksplan en de toepasselijke regelgeving.
- Bescherming van de rechten, veiligheid en welzijn van de proefpersonen onder de hoede van de onderzoeker.
- Controle van de therapie(ën) die worden onderzocht.
- Clinical Research Coordinator (CRC): Een CRC beheert en voert de dagelijkse studieactiviteiten uit in overeenstemming met het protocol, de toepasselijke regelgeving, en Goede klinische praktijk (GCP) en Institutionele beoordelingscommissie (IRB ) vereisten.
- Subonderzoeker (Sub I): De Sub I is lid van het door de PI aangewezen en begeleide onderzoeksteam om kritische studiegerelateerde procedures uit te voeren en/of belangrijke studiegerelateerde beslissingen te nemen.
- Klinisch onderzoek Verpleegkundig Coördinator (CRNC): Voor bepaalde protocolgerelateerde activiteiten kan een CRNC vereist zijn.
- Regelgevend Coördinator: De regelgevende coördinator bereidt en onderhoudt IRB-inzendingen en FDA-documenten. Kan ook studievoortgang volgen.
- Hoofdonderzoeker (PI): Een PI is de hoofdonderzoeker of clinicus die de klinische proef uitvoert. De PI is verantwoordelijk voor:
Nadat de gegevens uit het onderzoek zijn verzameld, analyseert het klinische onderzoeksteam deze om de belangrijkste bevindingen te identificeren. Het team gebruikt deze bevindingen om te bepalen wat te doen met de therapie. De volgende stap zou de volgende fase van klinische proeven kunnen zijn als de gegevens er veelbelovend uitzien en de regelgevende instantie het daarmee eens is. Als de therapie echter niet voldoet aan de gestelde veiligheids- en/of werkzaamheidsnormen, wordt er geen verder onderzoek gedaan.
Wat betekent indicatie en waarom is het belangrijk?
de "ikndication" voor een drug verwijst naar het gebruik van dat medicijn voor de behandeling van een bepaalde ziekte/stoornis. Een medicijn kan meer dan één FDA-gelabelde indicatie hebben, dit betekent dat het voor meerdere medische aandoeningen kan worden gebruikt. De primaire rol van de indicatie-etikettering is om zorgverleners in staat te stellen gemakkelijk geschikte therapieën voor patiënten te identificeren door de goedgekeurde indicatie(s) van het geneesmiddel duidelijk te communiceren.
Off-label gebruik
Bij het bekijken van uw behandelopties kan uw zorgverlener besluiten om u een off-label medicijn anders te laten gebruiken dan hoe het normaal wordt voorgeschreven of waarvoor het is geïndiceerd. Off-Label gebruik wordt gedefinieerd als het gebruik van een Door de FDA goedgekeurde medicatie wordt gebruikt op een manier die niet door de FDA is goedgekeurd via een standaard klinische proef voor veiligheid en werkzaamheid.
Voorbeelden van off-label gebruik kunnen zijn, maar zijn niet beperkt tot:
-
Wanneer een medicijn wordt gebruikt voor een aandoening waarvoor het niet is goedgekeurd om te behandelen
-
Wanneer een medicijn anders wordt gedoseerd dan is goedgekeurd
-
Kinderen behandelen met een medicijn dat alleen is goedgekeurd voor gebruik bij volwassenen
Off-label gebruik kan uiteindelijk worden goedgekeurd door de FDA.
Verzekeringsdekking
Een indicatie is ook belangrijk op het gebied van verzekeringen en medische facturering. Sommige medische verzekeringen dekken mogelijk niet het "off-label" gebruik van medicijnen. Medicare Part D dekt alleen medicijnen die zijn voorgeschreven voor off-label gebruik als de medicijnen zijn geïdentificeerd als veilig en effectief voor dat gebruik in een van de drie officieel erkende medicijncompendia. "Compendia" zijn encyclopedieën van chemische stoffen, met informatie over dosering en gebruik.
Er zijn zeker risico's bij het afleiden van een indicatie uit de diagnose, vooral als de voorschrijver medicatie gebruikt voor een off-label doel.
Wat is een protocol?
Een protocol is een studieplan waarop elke klinische studie is gebaseerd. Het plan is zorgvuldig ontworpen om de gezondheid van de deelnemers te beschermen, evenals:
specifieke onderzoeksvragen beantwoorden. Een protocol beschrijft welke soorten mensen aan het onderzoek mogen deelnemen; het schema van tests, procedures, medicijnen en doseringen; en de duur van de studie.
Wat is een placebo?
Een placebo is een inactieve pil, vloeistof of poeder die geen behandelingswaarde heeft. In klinische onderzoeken worden onderzoeksbehandelingen vaak vergeleken met placebo's om de effectiviteit van de onderzoeksbehandeling te beoordelen. In sommige onderzoeken krijgen de deelnemers in de controlegroep een placebo in plaats van een actief medicijn of experimentele behandeling.
Wat is een controlegroep?
Een controle is de standaard waarmee onderzoeksobservaties worden geëvalueerd. In veel klinische onderzoeken krijgt één groep studiedeelnemers een onderzoeksgeneesmiddel of -behandeling (ook wel "studie" genoemd), terwijl de controlegroep ofwel een standaardbehandeling voor de ziekte of een placebo krijgt.
Mag ik kiezen in welke groep ik deelneem? (Experimenteel of controle)
Nee, elke persoon die ermee instemt deel te nemen aan een klinische proef waarin een onderzoeksgeneesmiddel of -apparaat wordt vergeleken met een standaardbehandeling of placebo, wordt willekeurig
toegewezen (dat wil zeggen, bij toeval) aan een van de groepen. Over het algemeen kennen de deelnemer en het klinische onderzoeksteam de groepsopdracht niet
tot na afloop van de studie.
Wat maakt het uit of ik weet of het klinische teamonderzoeksteam weet in welke groep ik zit?
Kennis van deze informatie kan van invloed zijn op de rapportage van een deelnemer of studieteam over hoe de zaken in het onderzoek gaan. Als bijvoorbeeld de
deelnemer en/of onderzoeksteam weet dat de deelnemer in de onderzoeksgroep zit, kan een bijwerking zoals huiduitslag worden gemeld als zijnde
‘waarschijnlijk’ gerelateerd aan het onderzoeksgeneesmiddel, in plaats van ‘mogelijk gerelateerd’. Of de deelnemer meldt mogelijk vaker bijwerkingen dan wanneer hij/zij niet op de hoogte was van de groepsopdracht. Als de deelnemer en/of het onderzoeksteam echter weet dat de deelnemer in de controle-/placebogroep zit, wordt de huiduitslag gerapporteerd als "niet-gerelateerd" en, nog belangrijker, de deelnemer in deze groep zou onbedoeld een verslechtering van zijn/haar klachten kunnen melden. ziekte of aandoening, wanneer er geen verandering is opgetreden.
Wat betekent enkelblind of dubbelblind onderzoek?
“Blinden” is een procedure waarbij een of meer personen in de onderzoeksstudie op de hoogte worden gehouden van de behandelopdracht(en). Single-blind betekent meestal dat de onderzoeksdeelnemer niet op de hoogte wordt gesteld van de behandelopdracht. Dubbelblind betekent meestal dat de onderzoeksdeelnemer, onderzoeker, onderzoekscoördinator/verpleegkundige, onderzoekssponsor en in sommige gevallen de data-analist niet op de hoogte worden gehouden van de behandelopdracht. Het doel van een "geblindeerde" onderzoeksopzet is het wegnemen van de onbedoelde vertekening die de interpretatie van de verzamelde onderzoeksinformatie kan beïnvloeden, als de behandelopdracht bekend is. Als de veiligheid van de deelnemer dit vereist, kan een onafhankelijke Data Safety Monitoring Board de onderzoeker snel vertellen welke behandelopdracht een deelnemer heeft gekregen; dit vereist echter over het algemeen dat de deelnemer zich terugtrekt uit verdere deelname aan dat onderzoek.
Is een bijwerking hetzelfde als een bijwerking?
Nee, deze twee termen hebben niet dezelfde betekenis. Een bijwerking (of ervaring) beschrijft een ongunstige gebeurtenis of ervaring die optreedt nadat een deelnemer met het onderzoek is begonnen. De gebeurtenis of ervaring kan worden gemeld door de onderzoeksdeelnemer (zoals "Ik was de hele dag duizelig") of waargenomen door de onderzoeker (zoals een abnormaal laboratoriumtestresultaat). Het optreden van een ongunstige ervaring of gebeurtenis betekent niet noodzakelijk dat deze verband houdt met (of wordt veroorzaakt door) het experimentele medicijn, het apparaat of de behandeling. Over het algemeen wordt een bijwerking/ervaring als een "bijwerking" beschouwd wanneer, nadat het onderzoek is voltooid, de gebeurtenis veel vaker voorkwam bij deelnemers in de experimentele groep dan in de controlegroep.
Vragen om te stellen
Iedereen die geïnteresseerd is in deelname aan een klinische studie, moet zoveel mogelijk weten over de studie en zich op zijn gemak voelen om het onderzoeksteam vragen te stellen over de studie, de gerelateerde procedures en eventuele kosten. De volgende vragen kunnen nuttig zijn tijdens zo'n gesprek. Antwoorden op een aantal van deze vragen vindt u in de geïnformeerde toestemming document. Veel van de vragen zijn specifiek voor klinische onderzoeken, maar sommige zijn ook van toepassing op observationele onderzoeken.
- Wat wordt er bestudeerd?
- Waarom denken onderzoekers dat de interventie die wordt getest effectief kan zijn? Waarom zou het niet effectief kunnen zijn? Is het al eerder getest?
- Wat zijn de mogelijke interventies die ik tijdens de studie zou kunnen krijgen?
- Hoe wordt bepaald welke interventies ik krijg (bijvoorbeeld bij toeval)?
- Wie weet welke interventie ik krijg tijdens het proces? Zal ik het weten? Zullen leden van het onderzoeksteam het weten?
- Hoe verhouden de mogelijke risico's, bijwerkingen en voordelen van deze studie zich tot die van mijn huidige behandeling?
- Wat zal ik moeten doen?
- Om welke tests en procedures gaat het?
- Hoe vaak moet ik naar het ziekenhuis of de kliniek?
- Zal ziekenhuisopname nodig zijn?
- Hoe lang duurt de studie?
- Wie betaalt mijn deelname?
- Krijg ik andere kosten vergoed?
- Welk type langdurige nazorg maakt deel uit van deze studie?
- Als ik baat heb bij de interventie, mag ik deze dan blijven ontvangen nadat de proef is afgelopen?
- Worden de resultaten van het onderzoek aan mij verstrekt?
- Wie houdt toezicht op mijn medische zorg terwijl ik aan de studie deelneem?
- Wat zijn mijn mogelijkheden als ik geblesseerd ben tijdens het onderzoek?

